| Generalidades | Material y reactivos | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | Pregunta 3 |
El sodio es el sexto elemento en
orden de abundancia en la corteza terreste, es por esto y por la solubilidad
de sus sales, que casi siempre esta presente en la mayoría de las
aguas naturales. Su cantidad puede variar desde muy poco hasta valores
apreciables.
Altas concentraciones de sodio
se encuentran en las salmueras y en las aguas duras que han sido ablandadas
con el proceso de intercambio ciclo sodio.
La relación entre sodio
y los cationes totales es de importancia en la agricultura y en la patología
humana.
La permeabilidad de los suelos,
es afecta negativamente cuando se riega con agua de alta relación
de sodio.
A las personas que tienen una alta
presión arterial, se les recomienda ingerir agua y alimentos de
bajo contenido de sodio.
Cuando se requiere, se puede eliminar
el sodio, por procesos de intercambio ciclo hidrógeno, por destilación
o por osmosis inversa.
1.1.- Almacenaje de la muestra
Las muestras para análisis del sodio se deben
almacenar en frascos de polietileno o polipropileno.
No deben ser guardadas en recipientes de vidrio suave,
ya que existe la posibilidad de contaminación con los elementos
que forman el vidrio.
1.2.- Campo de aplicación
Este método de análisis
es aplicable a muestras que contengan sodio dentro de los intervalos de
concentración siguiente:
De 0 a 1, 0-10
y de 0-100 mg/l. Para cada uno de los intervalos de deberá
elaborar una curva de calibración estandar.
2.2.- Interferencias
Las partículas que contiene la muestra pueden tapar
el mechero, por lo que se recomienda filtrar esta antes de su análisis.
El calcio y el potasio pueden causar interferencias si se encuentran en
mayor cantidad que el sodio, 5:1 en el caso del potasio y 10:1 en el caso
del calcio.
Para minimizar el problema de las interferencias, se
recomiendan las siguientes acciones:
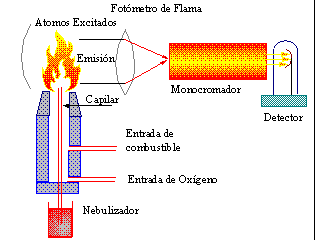
Espectrofotómetro de flama, ya sea de lectura directa o de estandar interno. Consulte la referencia de fabricantes para seleccionar el mas adecuado para su aplicación. Fabricantes
4.- Material1 Matraz volumétrico de 1000 ml
6 matraces volumétricos de 100 ml.
1 Cápsula de porcelana
Pipetas volumétricas de 10 ml, 5 ml y de 1 ml.
Bureta de precisión de 25 ml
Para evitar la contaminación por sodio, todo el material de vidrio deberá ser lavado con una solución diluida de ácido nítrico 1:25 y enjuagada varias veces con agua destilada.
4.1.- Reactivos
Solución patrón de Na +
Disolver 0.2543 gr. de NaCl secado a 140o
C. durante 2 horas y aforar a 1000 ml. Con agua destilada.
Esta solución contine 0.1 mg de Na +
por cada ml.
Se prepara una serie de diluciones de la solución patrón con agua destilada, de acuerdo a la siguiente tabla:
| ppm Na + | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| ml sol. patrón | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| Aforar a ml | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
Coloque el fotómetro de flama apartado de la luz
del sol o fuentes de luz indirecta, evite corrientes de aire, polvo humos
y contaminación por jabones, detergentes, sudor y material mal enjuagado.
Considerando las diferencias entre marcas y modelos de
los fotómetros de flama comerciales, sería imposible formular
instrucciones detalladas para el manejo y operación.
Se recomienda leer cuidadosamente el instructivo de operación
y mantenimiento del equipo en uso.
Los parametros que generalmente se deben considerar son
los siguientes:
* Escoger la fotocelda, la longitud de onda y la ranura
adecuada.
* La sensibilidad requerida para el análisis.
* Las presiones adecuadas de combustible , aire u oxígeno.
* El procedimiento de encendido, calentamiento, corrección
de la señal de fondo de la flama.
* Lavado del quemador. Introducción , quemado
de la muestra y medida de la emisión.
* Limpieza del quemador y Apagado del equipo.
Se dan alguna recomendaciones para la operación del fotómetro de flama en uso en los laboratorios de la UAM Reynosa-Aztlán que servirán como guia:
Encendido del fotómetro de flama:
Conectar a la corriente eléctrica 110 volts.
Abrir el tanque de gas LP, regular la presión
a 5 lb/pul2 y encender la flama
Abrir el tanque del oxígeno y regular la presión
de salida a 15 lb/in2
Apagado del fotómetro de flama:
Cerrar el tanque de oxígeno y la válvula
Cerrar el tanque de gas y la válvula de salida.
NOTA: La secuencia de encendido y apagado, se deberá seguir estrictamente en el orden anotado para evitar posibles explosiones.
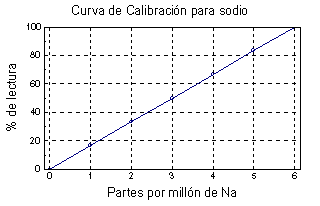
Curva de calibración:
Preparar una curva de calibración con los siguientes
puntos : 0, 1, 3, 4, 5, y 6 ppm de Na+
Ajustar el 0 % de lectura con agua destilada y los botones
de Blanc.
Ajustar a 60 % de lectura con la solución de 6
ppm de Na+ con los botones de la sensibilidad (fine and coarse)
.
Ya calibrada a 0 y 60 % de lectura, leer las soluciones
restantes.
Graficar el % lectura. contra las ppm de Na+
Análisis de una muestra:
Calibrar el fotómetro de flama a 0 % Lectura con
agua destilada
Calibrar el flamómetro a 60 % Lectura con la solucion
de 6 ppp de Na +
Introducir la muestra o su dilución y leer el
% de Lectura
Determinar las partes por millón de Na +
con la ayuda de la curva de calibración.
Determine los meq/lt de Na+ ( miliequivalentes por litro ) de acuerdo a la siguiente fórmula:
meq/lt Na + = ( ppm )*( FD ) / peso equiv del Na+
ppm: ppm de sodio en la muestra, de la curva de calibración
FD: Factor de dilución
Peso equiv. del Na + = 22.99
Este método tiene un error relativo de 4.0 % tal como se determinó en un estudio interlaboratorios.
American Society for testing and Materials. Annual book
of Standards 1994
Determinación de sodio en agua. Metodo ASTM D
2791-93
Standard methods for the examinatión of water and
waste water publicado por la APHA.
Determinación de Sodio en Agua. Método
3500 Na-D 1995
| Generalidades | Material y reactivos | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | Pregunta 3 |