| Generalidades | Material y reactivos | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | Pregunta 3. |
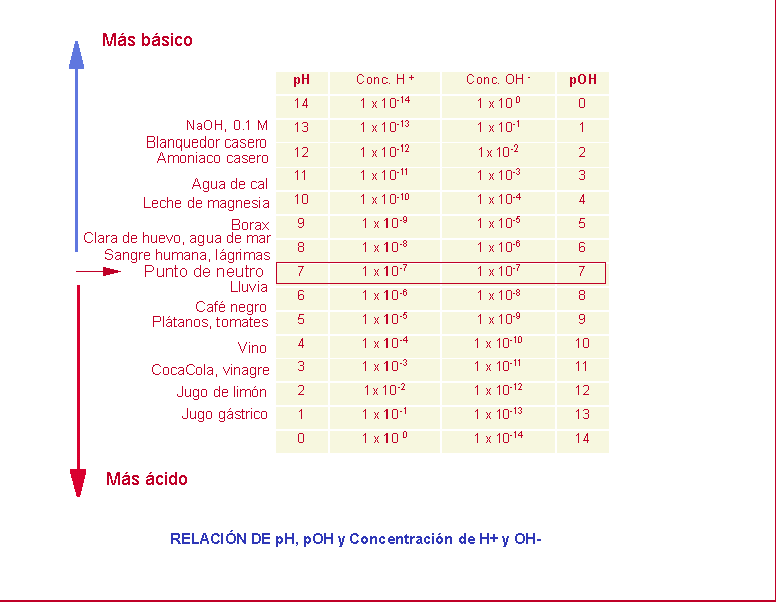
En 1909, el químico danés Sorensen
definió el potencial hidrógeno ( pH
) como el logarítmo negativo de la concentración molar (
mas exactamente de la actividad molar ) de los iones hidrógeno.
Esto es:
pH = - log [H + ]
Desde entonces, el término
pH ha sido universalmente utilizado por la facilidad de su uso, evitando
asi el manejo de cifras largas y complejas. Por ejemplo, una concentración
de [H+] = 1x10-8 M ( 0.00000001)
es simplemente un pH de 8 ya que
: pH= - log[10-8] = 8 La relación entre
pH y concentración de iones H se puede ver en la siguiente tabla,
en la que se incluyen valores típicos de algunas sustancias conocidas:

Las muestras para determinar pH, deberán ser tomadas en recipientes de polipropileno y asegurándose que estén bien tapadas, se recomienda analizar el pH lo más pronto posible y evitar la exposición al aire, en especial las muestras de aguas alcalinas, ya que el CO2 del aire, tiende a reaccionar con la alcalinidad de la muestra y variar su pH.
1.2.- Campo de aplicación
Este método
de prueba se utiliza para la determinación rutinaria del pH en agua,
a condiciones controladas de laboratorio .
La determinación del pH en el agua es una medida
de la tendencia de su acidez
o de su alcalinidad. No mide el valor de la acidez o alcalinidad ( vea
el método de determinación de alcalinidad ).
Un pH menor de 7.0 indica una tendencia
hacia la acidez, mientras que un valor mayor de 7.0 muestra
una tendencia hacia lo alcalino.
La mayoría de las aguas naturales tienen un pH
entre 4 y 9, aunque muchas de ellas tienen un pH ligeramente básico
debido a la presencia de carbonatos y bicarbonatos. Un pH muy ácido
o muy alcalino, puede ser indicio de una contaminación industrial.
El valor del pH en el agua, es utilizado también
cuando nos interesa conocer su tendencia corrosiva o incrustante,
y en las plantas de tratamiento de agua.
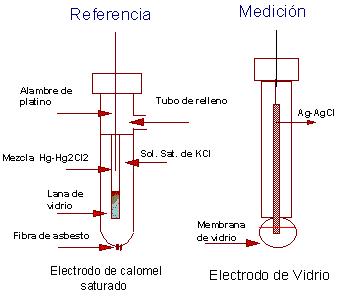
Este método determina el pH , midiendo
el potencial generado ( en milivolts ) por un electrodo de vidrio
que es sensible a la actividad del ión H+
, este potencial es comparado contra un electrodo de referencia,
que genera un potencial constante e independiente del pH. El electrodo
de referencia que se utiliza es el de calomel saturado con cloruro de potasio,
el cual sirve como puente salino que permite el paso de los milivolts generados
hacia al circuito de medición.
La cadena electroquímica de este sistema
de medición es :
Hg / Hg2Cl2-Sol Sat
KCl // Vidrio/HCl 0.1N/Ag-AgCl
En el siguiente esquema se muestran los electrodos
utilizados:
2.1.- Interferencias
El electrodo de vidrio es relativamente inmune a las interferencias
del color, turbidez, material coloidal, cloro libre, oxidantes y reductores.
La medición se afecta cuando la superficie de la membrana de vidrio
esta sucia con grasa o material orgánico insoluble en agua, que
le impide hacer contacto con la muestra, por lo anterior se recomienda
la limpieza escrupulosa de los electrodos.
En muestras de un pH mayor a 10 , se presenta el
error del sodio, el
cual puede ser reducido utilizando electrodos especiales de bajo error
de sodio y haciendo las correcciones indicadas en el instructivo del electrodo.
La temperatura tiene dos efectos de interferencia, el
potencial de los electrodos y la ionización de la muestra varian.
El primer efecto puede compensarse haciendo un ajuste en el botón
de la " temperatura" que tienen todos los aparatos. El segundo efecto es
inherente de la muestra y solo se toma en consideración, anotando
la temperatura de la muestra y su pH; para más exactitud, se recomienda
que la muestra esté a 25 ° C, que es la temperatura de referencia
para la medición del pH.
Medidor de pH de laboratorio:
La tabla siguiente, muestra las características
típicas más importantes de cuatro tipos de aparatos. Cualquier
aparato, junto con sus electrodos asociados ( vidrio y referencia ) , pueden
ser usados, la elección será de acuerdo a la precisión
deseada en la medición,
|
|
|
|
|
|
| Escala normal |
|
|
|
|
| Escala expandida |
|
|
|
. |
| División de la escala |
|
|
|
|
| Exactitud |
|
|
|
|
| Repetibilidad |
|
|
|
|
| Corrección por Temp | . | . | . | . |
| Manual o Automática |
|
|
|
|
| Intervalo en ° C |
|
|
|
|
| División menor ° C |
|
|
|
|
| Corrección - pendiente |
|
|
|
|
Material común de laboratorio para contener la
muestra y las soluciones para calibrar:
Vasos de precipitado, probetas ya sean de vidrio o de
plástico.
4.1.- Reactivos
Solución amortiguadora
de pH 4.00 a 25 ° C
Disolver 10.12 g de biftalato de potasio ( KHC8H4O4
) en agua destilada y diluya a un litro.
Solución amortiguadora
de pH 6.86 a 25 ° C
Disolver 3.39 g de Fosfato monopotásico ( KH2PO4
) y 3.53 g de Fosfato disódico anhidro ( Na2HPO4)
en agua destilada y diluya a un litro.
Solución amortiguadora
de pH 9.18 a 25 ° C
Disolver 3.80 g de Tetraborato
de sodio decahidratado ( Na3B4O7.10H2O
) en agua destilada y diluya a un litro.
Estas soluciones deben prepararse con agua destilada
y recién hervida durante 15 minutos y enfriada, lo anterior es para
eliminar la contaminación del CO2 disuelto en el agua
y evitar crecimientos microbianos.
Los fosfatos de sodio y potasio y el biftalato de potasio
se deben secar a 110 ° C durante 2 horas
antes de pesarlas.
El tetraborato de sodio decahidratado ( Borax ) no
debe ser secado a la estufa.
Las soluciones amortiguadoras preparadas, se deben guardar
en frascos de vidrio o de polipropileno, bien tapadas y prepararse cada
mes.
Anotar el valor del pH con las cifras significativas de acuerdo a la precisión del medidor de pH que se esté utilizando. Anotar también la temperatura de la muestra al determinarle el pH.
8.- Precisión:La precisión que se puede obtener con una cuidadosa
calibración del aparato y electrodos,
será de +/- 0.05 unidades de pH
American Society for testing and Materials. Annual book
of Standards 1994
Determinación de pH en el agua. Metodo ASTM
D 1293-84 reaprobado en 1990
Standard methods for the examinatión of water and
waste water publicado por la APHA.
Determinación de pH en agua. Médodo 4500-H+
B 1995
| Generalidades | Material y reactivos | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | Pregunta 3 |