| Generalidades | Material | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | Pregunta 3 |
Los sulfatos se encuentran en las aguas naturales en un
amplio intervalo de concentraciones.
Las aguas de minas y los efluentes industriales
contienen grandes cantidades de sulfatos provenientes de la oxidación
de la pirita y del uso del ácido sulfúrico.
Los estandares para agua potable
del servicio de salud pública tienen un límite máximo
de 250 ppm de
sulfatos, ya que a valores superiores tiene una acción "purgante
".
Los límites de concentración, arriba de
los cuales se precibe un sabor amargo en el agua son:
Para el sulfato de magnesio 400 a 600 ppm
y para el sulfato de calcio son de 250 a 400 ppm.
La presencia de sulfatos es ventajosa en la industria
cervecera, ya que le confiere un sabor deseable al producto.
En los sistemas de agua para uso doméstico, los
sulfatos no producen un incremento en la corrosión de los accesorios
metálicos, pero cunado las concentraciones son superiores a
200 ppm, se incrementa la cantidad de plomo disuelto proveniente
de las tuberías de plomo.
1.1.- Almacenaje de la muestra
Hay que anotar, que si la muestra contiene materia
orgánica y cierto tipo de bacterias ( sulfato reductoras),
los sulfatos son reducidos por las bacterias a sulfuros. Para evitar lo
anterior, las muestras que tengan alta contaminación, se deben almacenar
en refrigeración o tratadas con un poco de formaldehido.
Si la muestra contiene sulfitos, estos reaccionan a un
pH superior a 8.0, con el oxígeno disuelto del agua y pasan a sulfatos,
se evita esta reacción, ajustando el pH de la muestra a niveles
inferiores a 8.0.
Aparte de los casos especiales mencionados, la muestra
no requiere de un almacenaje especial.
1.2.- Campo de aplicación
Este método analiza sulfatos en un intervalo de
0 a 25 ppm, en muestras de agua de uso doméstico, industrial y agrícola.
Si la concentración de sulfatos es superior a
25 ppm, se diluye según sea necesario.
La muestra es tratada con cloruro de bario, en medio ácido,
formándose un precipitado blanco de sulfato de bario, se requiere
de un solvente acondicionador, que contiene glicerina y alcohol,
para modificar la viscosidad de la muestra y así permitir que el
precipitado de BaSO4 se mantenga en suspensión, produciendo
valores de turbidez estables .
La turbidez de este precipitado se mide en un espectrofotometro
a una longuitud de onda de 420 nm y con una celda
de 1 cm.
Na+ ]
Na+ ]
K+ ]
H+
K+ ]
Ca++ ] SO4=
+ BaCl2.H20 --------> BaSO4
+ Ca++
] Cl-
Mg++ ]
Mg++ ]
2.1- Interferencias
En este método las principales interferencias
son los sólidos suspendidos, materia orgánica y sílice,
las cuales pueden ser eliminadas por filtración antes del análisis
de sulfatos.
Cualquier espectrofotómetro que se pueda operar a una longitud de onda de 420 nanometros, con celdas de de 1 cm ( Spectronic-20).
4.- Material
1 Matraz volumétrico de 1000
ml
6 matraces volumétricos de
100 ml
7 Matraces Erlenmeyer de 125 ml
1 Cápsula de porcelana
1 Soporte con pinzas para bureta
1 Bureta de 25 ml
1 Pipeta de 5 y 10 ml.
Reactivo de BaCl2 .
2H2O (tamaño de partícula: malla 20 a 30)
Se requieren 0.5 g de cristales para cada muestra
.
Solución patrón
de 100 ppm de SO4=
Disolver 0.1479 g de Na2SO4 secados
a 110 ºC durante 2 horas y aforar a 1000 ml.
Curva de calibración de
sulfatos
Preparar una curva de calibración con los siguientes
puntos: 0, 5, 10, 15, 20 y 25 ppm de SO4=
Se colocan en 6 matraces volumétricos de 100 ml
los siguientes volúmenes de solución estandar de 100 ppm
de SO4= : 0, 5, 10, 15, 20 y 25 ml, se afora
con agua destilada hasta la marca.
Continúe los pasos marcados en el procedimiento,
para desarrollar la turbidez.
Grafique absorbancia contra las p.p.m. de SO4= 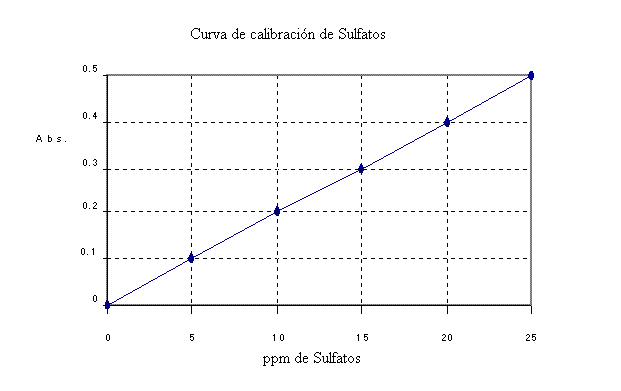
6.2.- Muestra
Colocar 10 ml de la muestra de agua en un matraz Erlenmeyer
de 50 ml.
Añadir 1 ml de la solución ácida
acondicionadora.
Mezclar bien
Agregar 0.5 g de BaCl2 . 2H2O
Agitar durante 1 minuto.
Transferir la muestra a una celda de 1 cm del espectrofotómetro
y leer la absorbancia a una longitud de onda de 420 nm dentro
de los 2 minutos siguientes.
De la curva de calibración: Obtenga las ppm
de SO4 = , de acuerdo con la lectura de absorbancia
de la muestra.
En caso de utilizar diluciones, se multiplica por el
factor de dilución correspondiente.
( ppm)(dilución)
Meq./ l de SO4= -----------------------
PE del SO4
PE : Peso equivalente del ión sulfato = 48.0 g
En estudios efectuados entre laboratorios y utilizando una muestra sintética, se encontro una desviación estandar relativa de 9 % y un error relativo de 1.9 %
9.- Bibliografía:American Society for testing and Materials. Annual book
of Standards 1994
Determinación de Sulfatos por turbidimetría
en agua.
Metodo ASTM D 516-90
Standard methods for the examinatión of water and
waste water publicado por la APHA.
Determinación de Sulfatos por turbidimetría
en agua. Método 4500 SO4-2 A-E, 1995
| Generalidades | Material | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | Pregunta 3 |