| Generalidades | Material y reactivos | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | . |
La DUREZA
es una característica química
del agua que esta determinada por el contenido de carbonatos, bicarbonatos,
cloruros, sulfatos y ocasionalmente nitratos de calcio
y magnesio .
La dureza es indeseable en algunos
procesos, tales como el lavado doméstico e industrial, provocando
que se consuma más jabón, al producirse sales insolubles.
En calderas y sistemas enfriados
por agua, se producen incrustaciones en las tuberías y una pérdida
en la eficiencia de la transferencia de calor.
Además le da un sabor indeseable
al agua potable.
Grandes cantidades de dureza son
indeseables por razones antes expuestas y debe ser removida antes de que
el agua tenga uso apropiado para las industrias de bebidas, lavanderías,
acabados metálicos, teñído y textiles.
La mayoría de los suministros
de agua potable tienen un promedio de 250 mg/l de dureza.
Niveles superiores a 500 mg/l son
indesables para uso dómestico.
La dureza es caracterizada comunmente por el contenido de calcio y magnesio y expresada como carbonato de calcio equivalente.
Existen dos tipos de DUREZA:
Dureza Temporal: Esta determinada por el contenido de carbonatos y bicarbonatos de calcio y magnesio. Puede ser eliminada por ebullición del agua y posterior eliminación de precipitados formados por filtración, también se le conoce como "Dureza de Carbonatos".
Dureza Permanente: está
determinada por todas las sales de calcio y magnesio excepto carbonatos
y bicarbonatos. No puede ser eliminada por ebullición del agua y
también se le conoce como "Dureza de No carbonatos".
Interpretación de la Dureza:
Dureza como CaCO3 Interpretación
0-75
agua suave
75-150
agua poco dura
150-300
agua dura
> 300
agua muy dura
______________________________________
En agua potable
El límite maximo permisible es de 300 mg/l de dureza.
En agua para calderas
El límite es de 0 mg/l de dureza
1.1.- Almacenaje de la muestra
La muestra puede ser recolectada y almacenada en un recipiente de plástico, bién tapado.
1.2.- Campo de aplicación
El análisis de la dureza total en muestras de aguas es utilizado en al industria de bebidas, lavandería,fabricación de detergentes, acabados metálicos, teñído y textiles. Además en el agua potable, agua para calderas ,etc.
2.- Principios2.1.- Principios
La muestra de agua que contiene los iones calcio y magnesio
se le añade el buffer de PH 10, posteriormente, se le agrega
el indicador eriocromo negro T( ENT ), que hace que se forme un complejo
de color púrpura, enseguida se procede
a titular con EDTA (sal disódica) hasta la aparición de un
color azúl .
Reacciones:
Ca2+ + Mg2+ +
Buffer PH 10 --------->
Ca2+ + Mg2+ +
ENT ----------->[Ca-Mg--ENT]
complejo púrpura
[Ca-Mg--ENT] + EDTA ------------->[Ca-Mg--EDTA] + ENT
color azúl
2.2.- Interferencias
En la tabla se encuentran la lista de la mayor parte
de las sustancias que interfieren. Sí existen más de una
sustancia interferentes, los límites dados en la tabla pueden variar.La
turbidez se elimina por filtración .
Interferencias
Con. máx. sin interferir
Alumnio--------------------------20 ppm
Cadmio--------------------------- *
Cobalto-------------------------100 ppm
Cobre--------------------------- 50 ppm
Fierrro(+3)-------------------- 50 ppm
Fierro (+2)--------------------- 50 ppm
Plomo-------------------------- *
Manganeso------------------- 1 ppm
Níquel------------------------- 100 ppm
Zinc----------------------------
*
Polifosfatos------------------ 10 ppm
* Si están presentes son titulados como
dureza.
El método empleado para la cuantificación de la Dureza Total es un método volumétrico por lo que no se requieren aparatos especiales.
2 matraces volumétricos de 1000
ml
2 matraces volumetricos de 100 ml
1 cápsula de porcelana
1 soporte con pinzas para bureta
2 matraces erlenmayer de 125 ml
1 pipeta de 10 ml
2 frascos goteros de 100 ml
4.1.- Reactivos
Solución Buffer PH 10
Disolver 6.56 gr. de NH4Cl y 57 ml de NH4OH
en agua destilada y aforar a 100 ml.
Solución De Eriocromo Negro
T
Disolver 0.5 g de Eriocromo negro T y 4.5 gr. de clorhidrato
de hidroxilamina en 100 ml de etanol.
Solución De EDTA (sal disódica)
Disolver 2 gr de EDTA (sal disódica) màs
0.05 gr de MgCl2.6H2O en agua destilada y aforar
a 1000 ml.
Solución de CaCl2
0.01 N Disolver 0.5 gr de CaCO3 secado a 110 ° centígrados
durante 2 horas y disolverlo en 10 ml de HCl 3N y aforar a 1000 ml con
agua destilada.
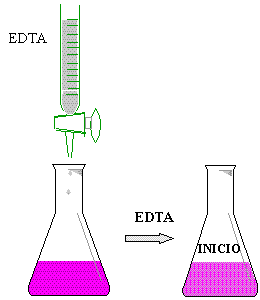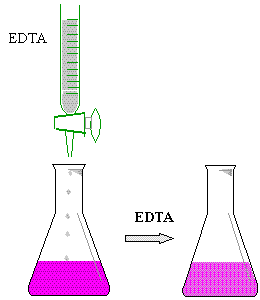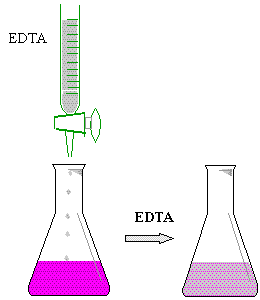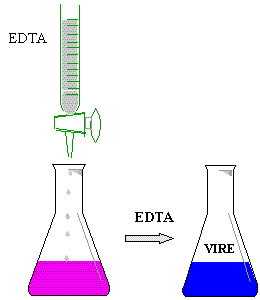
* Colocar 5 ml de la muestra de agua en un matraz erlenmayer
de 125 ml
* Agregar 5 gotas de buffer PH 10
* Añadìr 3 gotas de eriocromo negro T
* Titular con EDTA (sal disódica) 0.01 N
* Vire de púrpura
a azul
V x N x 1000
meq/l Ca+2 y Mg+2 = -----------------------
ml de muestra
Dónde :
V = ml gastados de EDTA
N = Normalidad del EDTA
Cálculos para Magnesio:
meq/l Mg+2 = [meq/l (Ca+2 y Mg+2)]-(meq/l Ca+2)
Cálculos para Dureza Total : Expresada como ppm de CaCO3
mg/l de Dureza Total = [ meq/l (Ca+2 y Mg+2)]* (50) como
Cálculos para Dureza de Calcio : Expresada como ppm de CaCO3
mg/l Dureza de Calcio = (meq/l Ca+2)* (50)
Cálculos para Dureza de Magnesio : Expresada como ppm de CaCO3
mg/l Dureza de Magnesio = (meq/l Mg+2)* (50)
8.- Precisión
Este método tiene un error relativo de 1.9% y una desviación estandar relativa de 9.2 %, tal como se determinaron en un estudio interlaboratorios.
9.- BibliografíaAmerican Society for testing and Materials. Annual book of Standards 1994 Determinación de dureza en agua. Metodo ASTM D 1126-92
Standard methods for the examinatión of water and
waste water publicado por la APHA.
Determinación de Dureza en agua Método
2340 C, 1995
| Generalidades | Material y reactivos | Cálculos | Pregunta 1 |
| Discusión General | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | . |