Determinación
de la Conductividad Eléctrica
1.- Generalidades
La conductividad eléctrica,
se define como la capacidad que tienen las sales inorgánicas en
solución
( electrolitos ) para conducir la corriente electrica.
El agua pura, practicamente no conduce la corriente,
sin embargo el agua con sales disueltas conduce la corriente eléctrica.
Los iones cargados positiva y negativamente son los que conducen la corriente,
y la cantidad conducida dependerá del número de iones presentes
y de su movilidad.
En la mayoría de las soluciones acuosoas, entre
mayor sea la cantidad de sales disueltas, mayor será la conductividad,
este efecto continúa hasta que la solución está tan
llena de iones que se restringe la libertad de movimiento y la conductividad
puede disminuir en lugar de aumentas, dándose casos de dos diferentes
concentraciones con la misma conductividad. ( ver Tabla )
Todos los valores de conductividad
están referidos a una tempertatura de referencia de 25 ° C
.
Valores de conductividad de
algunas muestras típicas
|
Temperatura de la muestra 25
° C
|
Conductividad, µS/cm
|
| Agua ultrapura |
0.05
|
| Agua de alimentación a calderas |
1 a 5
|
| Agua potable |
50 a 100
|
| Agua de mar |
53,000
|
| 5 % NaOH |
223,000
|
| 50 % NaOH |
150,000
|
| 10 % HCl |
700,000
|
| 32 % de HCl |
700,000
|
| 31 % HNO3 |
865,000
|
Algunas sustancias se ionizan en forma más completa
que otras y por lo mismo conducen mejor la corriente. Cada ácido,
base o sal tienen su curva característica de concentración
contra conductividad.
Son buenos conductores : los
ácidos, bases y sales inorgánicas: HCl, NaOH, NaCl, Na2CO3
....etc.
Son malos conductores :
Las moléculas de sustancias orgánicas que por la naturaleza
de sus enlaces son no iónicas: como la sacarosa, el benceno, los
hidrocarburos, los carbohidratos.... etc, estas sustancias, no se ionizan
en el agua y por lo tanto no conducen la corriente eléctrica.
Un aumento en la temperarura, disminuye la viscosidad
del agua y permite que los iones se muevan más rapidamente, conduciendo
más electricidad. Este efecto de la temperatura es diferente para
cada ion, pero tipicamente para soluciones acuosas diluidas, la conductividad
varía de 1 a 4 % por cada ° C.
Conociendo estos factores, la medición de la conductividad
nos permite tener una idea muy aproximada de la cantidad de sales disueltas.
1.1.- Almacenaje de la muestra
Las muestras se deben tomar en frascos de vidrio o polipropileno,
perfectamente tapados.
1.2.- Campo de aplicación
Este método de prueba es aplicable a la detección
de impurezas y en algunos casos a la medición cuantitativa de los
constituyentes iónicos disueltos presentes en el agua:
-
Verificación de la pureza del agua destilada y desionizada.
-
Verificar en forma rápida la variación del
contenido de sales disueltas en aguas superficiales, de uso doméstico
e industrial.
-
Analizar cuantitativamente los sólidos totales disueltos
en una muestra de agua. Esto se puede obtener, multiplicando el valor de
la conductividad por un factor de correlación empírico que
puede variar de 0.5 a 0.9, dependiendo de los componentes solubles y la
temperatura de la muestra. Este factor se puede determinar mediante análisis
comparativos de sólidos disueltos totales por evaporación
y determinaciones del valor de la conductividad correspondiente. Este factor
de correlación solo es válido cuando la muestra tiene un
pH entre 5 y 8 a valores mayores o menores del pH, los resultados no serán
confiables.
2.- Principios
La conductividad eléctrica es el recíproco
de la resistencia a-c en ohms, medida entre las caras opuestas de un cubo
de 1.0 cm de una solución acuosa a una temperatura especificada.
Esta solución se comporta como un conductor eléctrico donde
se pueden aplicar las leyes físicas de la resistencia eléctrica.
Las unidades de la conductividad eléctrica son
el Siemens/cm ( las unidades antiguas, erán los mhos/cm que
son numéricamente equivalentes al S/cm ).
En la práctica no se mide la conductividad entre
electrodos de 1 cm3 sino con electrodos de diferente tamaño,
rectangulares o cilíndricos, por lo que al hacer la medición,
en lugar de la conductividad, se mide la conductancia, la cual al ser multiplicada
por una constante ( k ) de cada celda en particular, se transforma en la
conductividad en S/cm.
Conductividad = Conductancia de la muestra
* k
k = d/A
k: Constante de la celda
d: distancia de la separación de los electrodos
A: Area
de los electrodos
Así, un electrodo de 1 cm de separación
y con area de 1 cm , tendrá una k = 1
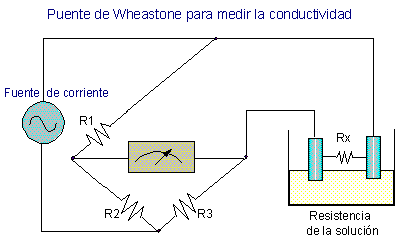
La medición eléctrica se efectúa
mediante un puente de Wheastone para medir resistencias.
Las resistencias R1 y R2 son fijas y su valor va de acuerdo
al intervalo de conductividad que se pretende medir. La resistencia Rx
es la que proporciona la solución a la cual se le va a medir la
conductividad. La resistencia R3 se varía en forma continua hasta
poner en equilibrio el puente, de
tal forma que no pase corriente hacia el medidor.
 2.1- Interferencias
2.1- Interferencias
-
La exposición de la muestra
al aire atmosférico, puede causar cambios en la conductividad,
debido a pérdida o ganancia de gases disueltos, en especial el CO2.
Esto es especialmente importante para aguas de alta pureza, con concentraciones
bajas de gases y sustancias ionizables. Para evitar
esto se debe tener una atmósfera
inerte de nitrógeno o helio sobre la muestra.
-
Sustancias no disueltas o materiales
que precipiten lentamente en la muestra, pueden causar ensuciamiento
en la superficie de los electrodos y causar lecturas erroneas.
-
El ensuciamiento por sustancias orgánicas,
bioensuciamientos y corrosión de los electrodos, causan lecturas
inestables o erroneas.
-
El factor de correlación para obtener los valores
cuantitativos de los sólidos totales disueltos solo es válido
cuando la muestra tiene un pH entre 5 y 8, a valores mayores o menores
de pH, los resultados no serán confiables. Se tendrá que
ajustar el valor del pH a cerca de 7.0 utilizando un
ácido o una base débil según sea necesario.


-
Conductímetro manual o automático
que se base en un puente de Wheastone para medir
la conductividad o la conductancia de la muestra. Debera tener corrección
automática o manual para la temperatura Ya que las lecturas
se refieren a 25 ° C. La lectura puede ser analógica
o digital.
-
Celdas del tipo de inmersión de constante de celda
de acuerdo con el circuito del aparato. Es necesario
leer el instructivo de operanción del equipo.
Fabricantes
4.- Material
Termómetro de 0 a 110 ° C
Vaso de precipitado de forma larga, de 100ml
4.1.- Reactivos
Alcohol etílico del 95 % (
Para el lavado de los electrodos )
Agua destilada ultra pura, especificación
ASTM D1193 Tipo I
Cloruro de potasio: de 100
% +/- 0.1 de pureza. Secarlo a 150 ° C durante 2 horas, guardarlo
en un desecador.
Solución estandar (1) de cloruro de
potasio KCl : Disolver 0.7440 g de KCl en agua destilada ASTM tipo
I y diluir a 1 litro. Esta solución tiene
una conductividad de 1408.8 µS/cm.
Solución estandar (2) de cloruro de
potasio KCl : Diluir 100 ml de la solución estandar (1) a 1000
ml en un matraz aforado y a 20 ° C. Esta solución tiene
una conductividad específica de 146.9 µS/cm.
5.- Estandarización
Para verificar el estado general del conductímetro,
se deben hacer mediciones de la conductividad de las soluciones estandar
1 y 2 y en su caso calibrar la lectura del instrumento a que den los valores
especificados.
6.- Procedimiento
Ya que hay un gran número de marcas y modelos de
conductímetros en el mercado, para un detallado procedimiento habrá
que referirse al manual de manejo del instrumento que se este usando.
A continuación enlisto algunas
recomendaciones para la medición
que aparecen en el instructivo de operación del conductímetro
Yellow Spring Instruments (YSI) modelo 32 ( medidor de conductancia ):
Después de escoger la celda de la constante adecuada,
observe los siguientes pasos para obtener resultados exactos y repetitivos:
-
La celda deberá estar limpia antes de hacer cualquier
medición.
-
La celda debe de estar suspendida en la solución de
tal manera, que los orificios de venteo estén sumergidos. La cámara
del electrodo no debe tener aire entrampado ( esto se logra inclinando
ligeramente la celda y golpeando suavemente los lados ).
-
La celda deberá estar separada de las paredes y el
fondo del recipiente, por lo menos 0.5 cm.
-
Si es posible, el recipiente o el sistema en donde se va
a hacer la medición deberá estar aislado del potencial de
la tierra. Si no es posble , el medidor YSI modelo 32 debera operarse sin
conexión a tierra.
-
La presencia de campos eléctricos y corrientes espurias
causadas por agitadores magnéticos, calentadores, etc., pueden causar
dificultad para obtener lecturas adecuadas. El usuario deberá evaluar
estos efectos y hacer las correcciones necesarias, utilizando cableado
blindado o desconectándolos por un momento al hacer la lectura.
-
Manejar la celda con cuidado, para evitar que se rompa o
que pierda su calibración.
-
La celda no se deberá transferir de una solución
a otra, no sin antes lavarla cuidadosamente.
-
No guarde la celda sucia o contaminada.
-
No debe lavarse la celda con Agua regia, ya que esta disolverá
la soldadura de oro que se utiliza en la construcción de las celdas
del medidor YSI modelo 32.

Si el instrumento da lecturas en conductancia:
Conductividad = Conductancia * k
k = Constante de la celda
Si el instrumento da lecturas en conductancia, anotar
el valor tal como se observa en la escala.
Para ambos casos el valor de la
conductividad está en microSiemen/cm; referido a una temperatura de 25 ° C.
8.- Precisión
Dentro del intervalo de 10 a 2,000 microSiemen/cm, la
precisión es de +/- 0.2 % de escala completa.
9.- Bibliografía:
American Society for testing and Materials. Annual book
of Standards 1994
Determinación de Conductividad eléctrica
del agua. Metodo ASTM D 1125-91
Standard methods for the examinatión of water and
waste water publicado por la APHA.
Medición de conductancia, Método 2510 B
- 1995
 A
página principal
A
página principal  Al Indice
Al Indice  Regresar Arriba
Regresar Arriba

