| Generalidades | Material y reactivos | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | Pregunta 3 |
El calcio es el 5º elemento
en orden de abundancia en la corteza terrestre, su presencia en las aguas
naturales se debe al su paso sobre depósitos de piedra caliza, yeso
y dolomita.
La cantidad de calcio puede variar
desde cero hasta varios cientos de mg/l, dependiendo de la fuente y del
tratamiento del agua.
Las aguas que contienen cantidades
altas de calcio y de magnesio, se les da el nombre de " aguas duras ".
Concentraciones bajas de carbonato
de calcio, previenen la corrosión de las tuberias metálicas,
produciendo una capa delgada protectora. Cantidades elevadas de sales de
calcio, se descomponen al ser calentadas, produciendo incrustaciones dañinas
en calderas, calentadores, tuberias y utensilios de cocina; también
interfieren con los procesos de lavado doméstico e industrial, ya
que reaccionan con los jabones, produciendo jabones de calcio insolubles,
que precipitan y se depositan en las fibras, tinas, regaderas, etc.
Es de interes que se consulte el
tema de " Saturación y estabilidad con respecto al carbonato de
sodio " ver: Indice de Langelier y de Ryznar.
Por medio de tratamientos químicos
o por intercambios iónicos, se puede reducir la cantidad de calcio
y los iones asociados a la dureza, hasta niveles tolerables.
1.1.- Almacenaje de la muestra
En el caso de que se precipite el carbonato de calcio, se deberá redisolver, añadiendo unas gotas de HCl 1:1 Por lo demás, no se requieren cuidados especiales de almacenaje de la muestra, salvo las precauciones normales que eviten la contaminación de la muestra por los recipientes de muestreo.
1.2.- Campo de aplicación
Este método es aplicable
a la determinación de Calcio en aguas de apariencia clara, su límite
inferior de detección es de 2 a 5 mg/l como CaCO3, su
límite superior, puede extenderse a cualquier concentración,
diluyendo la muestra.
Cuando se añade a una muestra de agua, ácido etilendiaminotetracético ( EDTA ) o su sal, los iones de Calcio y Magnesio que contiene el agua se combinan con el EDTA. Se puede determinar calcio en forma directa, añadiendo NaOH para elevar el pH de la muestra entre 12 y 13 unidades, para que el magnesio precipite como hidróxido y no interfiera, se usa además, un indicador que se combine solamente con el calcio.
Reacciones :
Ca+2
+ Mg+2 + NaOH (4N) ---------> Mg (OH)2 + Ca+2
Ca+2 + Murexide ---------> [Muréxide-
Ca++] (color rosa)
Las siguientes concentraciones de iones no causan interferencias en este método:
Este método no requiere de ningún aparato especial para ejecutarlo.
4.- MaterialSolución de NaOH 4N :
Disolver 16 g de NaOH en agua destilada y aforar a 100
ml.
Indicador de Murexide :
Mezclar 0.5 g de muréxide en 50 g de K2SO4
Solución de EDTA 0.01N :
Disolver 2 g de EDTA ( sal disódica ) y 0.05 g
de MgCl2. 6H2O en agua destilada
y aforar a 1000 ml.
Solución de CaCl2
0.01N :
Disolver 0.5 g de CaCO3 secado a 100 ºC.
durante 2 horas y disolverlo en 10 ml de HCl 3N. Aforarlo a 1000
ml con agua destilada.
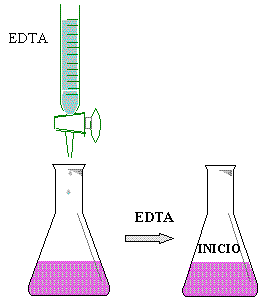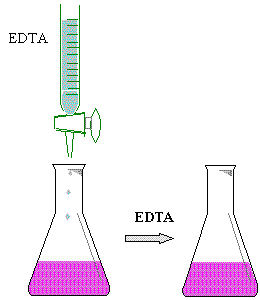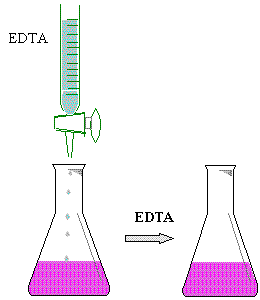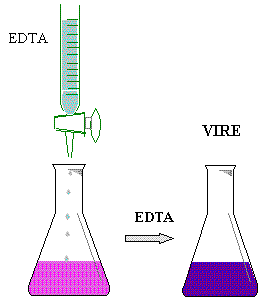
Colocar 5 ml de muestra de la solución de CaCl2 0.01 N en un matraz erlenmeyer de 125 ml, añadirle 5 gotas de NaOH 4N, enseguida agregarle 50 mg de Murexide y finalmente titular con EDTA ( sal disódica ) hasta un cambio de vire de rosa a púrpura.
Fórmula para el cálculo
de la normalidad de la solución de EDTA:
V1 x N1
N2 = ----------------
V2
N2 = Normalidad del EDTA
V1 = ml de solución de CaCl2
N1 = Normalidad de la solución de CaCl2
V2 = ml gastados de la solución de
EDTA
Colocar una alícuota de 5 ml. De agua en un matraz
E.M. de 125 ml.
Agregar 5 gotas de NaOH 4N.
Alícuotas de muestras dependiendo de su fuente:
| TIPO DE MUESTRA | CANTIDAD DE MUESTRA |
| Agua destilada |
|
| Agua purificada |
|
| Agua potable |
|
| Agua dura |
|
| Agua residual |
|
| Agua salina |
|
Este método tiene un error relativo de 1.9 % y una desviación estandar relativa de 9.2 %, tal como se determinaron en un estudio interlaboratorios.
American Society for testing and Materials. Annual book of Standards 1994 Determinación de dureza en agua. Metodo ASTM D 1126-92
Standard methods for the examinatión of water and
waste water publicado por la APHA,
Método 3500 Ca-D 1995 .
| Generalidades | Material y reactivos | Cálculos | Pregunta 1 |
| Principios | Estandarización | Precisión | Pregunta 2 |
| Aparatos | Procedimiento | Bibliografía | Pregunta 3 |